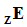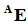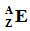В этой статье (или серии статей) я постараюсь ответить на вопросы, которые появились бы у меня самого, если бы я захотел узнать, что такое водород.
Начнём с глубокой этимологии (deep etymology).
Водород – первый элемент таблицы Менделеева (которой в этом году исполняется 150 лет).
Если касаться глубокой этимологии, то интересно происхождение самого слова "элемент". По одной из версий, оно образовано подряд идущими буквами из середины алфавита.
Действительно, и в кириллическом (ЛМН), и в латинском (LMN), и в греческом (λμν – лямбда, мю, ню) и даже в прародителе всех этих алфавитов финикийском (𐤍𐤌𐤋 – ламед, мем, нун) буквы "эл", "эм", "эн" идут подряд, причём в финикийском они расположены как раз в начале второй половины алфавита из 22 букв. То есть слово "элемент" относится к той же категории, что и слова "алфавит" (α "альфа" + β "бета", она же "вита"), "азбука" (азъ + буки), "абецедарий" (алфавит с названиями букв на другом языке), "ёклмн/ёпрст", а также "АБВГДейка" (кто-то ещё помнит?) и, как ни странно, название химического элемента "азот" (в некотором смысле оно построено по той же схеме). Возможно, кто-то вспомнит другие слова из этой же серии.
Здесь у вдумчивого читателя сразу может появиться множество других вопросов, но мы пока пойдём дальше (а вопросы можно обсудить в комментариях или в следующей статье).
Теперь, собственно, водород. Как известно, все "классические" химические элементы традиционно имеют латинские названия, обычно заканчивающиеся на -um/-ium. Для "новых" элементов это, вообще говоря, уже не совсем так – например, Теннессин (формально, последний из известных на сегодняшний день галогенов) официального латинского наименования не имеет (оно остаётся неопределённым). Но у водорода оно есть – Hydrogenium (гидрогениум). Его (вместе с французским hydrogène) предложил в 1783 году основатель современной химии Антуан Лавуазье, убедившийся, что при сжигании водорода образуется вода, а при разложении водяного пара раскалённым железом снова образуется водород – отсюда и произошло название: от др.-греч. ὕδωρ (hydor, гидор – "вода") и γεννάω (gennao, геннао – "рождаю") – т.е. буквально "рождающий воду".
Тут возникает ещё больше вопросов, и на некоторые из них мы попытаемся ответить.
Во-первых, где в слове ὕδωρ звук "г" (а он есть!). Если скопировать первую букву (ὕ), например, в Microsoft Word, выделить её и вызвать окно вставки символов, то в статусной строке можно прочитать полное название этого символа: "Greek Small Letter Upsilon With Dasia And Oxia", т.е. "греческая строчная буква ипсилон с дасией и оксией". Здесь нас интересует похожая на запятую "дасия", обозначающая "густое придыхание", она же "h" в латинице и "г" в кириллице. Пока вроде всё ясно.
Далее, сама буква υ ("ипсилон"). С ней всё гораздо сложнее и интереснее. Сама она произошла от финикийской буквы 𐤅 ("вав"), от которой в свою очередь также произошли (загибайте пальцы):
– (древне)греческие Ϝϝ ("дигамма" или "вав") и Υυ (собственно, "ипсилон");
– латинские Ff ("эф"), Yy ("ипсилон" или "игрек"), Uu ("у"), Vv ("вэ") и Ww ("дубль вэ");
– кириллические Ѵѵ ("ижица"), Ꙋꙋ ("ук"), Уу ("у") и Ўў ("у краткое").
Очень, очень плодовитая буква!
Само название "ипсилон" составное и обозначает "υ ψιλόν" – т.е. "и простое" (соответственно, "эпсилон" означает "ε ψιλόν" – т.е. "е простое"). Латинский "игрек" – тоже составное название, изначально обозначавшее "i graeca" – т.е. "и греческое" (сиречь "игрек"). В связи с этим есть простое общее правило: если в английском слове между двумя согласными встречается буква ⟨y⟩ ("ўай"), то это слово скорее всего имеет греческое происхождение. И наоборот: если вы в английском слове слышите греческий корень со звуком /ɪ/ ("и") между двумя согласными, то скорее всего звук /ɪ/ передаётся буквой ⟨y⟩. Например: etymology (от ἔτυμον, этимон – "правда, истина"), lyrics (от λύρα, лира – "лира, лирика"), physics (от φυσικός, физикос – "природный, натуральный"). Иногда помогает вспомнить правильное написание слова.
Думаю, теперь, после всего услышанного, уже совсем неудивительным покажется, что слова "гидро-", "гидра", "выдра" (англ. otter) и "вода" (англ. water) все имеют общее происхождение и вместе с греч. υδωρ/υδρο восходят к праиндоевропейскому корню *wed-/*wódr̥ ("вода"). Немецкое Wasser также отсюда, и по-немецки "водород" – Wasserstoff (Wasser – "вода" и Stoff – "материал, вещество").
Теперь обратим внимание на слово γενναω ("рождаю"): "ген", "гений" ("дух"), Евгений (букв. ευ "хорошо; добро" + γενος "род" – "благородный"; видимо, Евгений Онегин и крокодил Гена названы так совсем неспроста, но по разным причинам:), "генеалогия" ("родословная"), "генезис" ("происхождение") и многие другие разделяют с ним общее происхождение.
Обобщим полученную информацию и перечислим имена водорода на разных языках:
греч. Υδρογόνο /iðroˈɣono/ (изрогоно)
лат. Hydrogenium (гидрогениум)
англ. Hydrogen /'haɪdrəʤən/ (хайдроджен)
франц. Hydrogène /i.dʁɔ.ʒɛn/ (идрожен)
нем. Wasserstoff /ˈvasɐʃtɔf/ (васэштоф)
Как видим, всё выглядит довольно похоже:)
И, да: как это ни грустно, но буква Δδ в греческом уже больше не "дельта", а /ˈðel.ta/ ("зельта") и обозначает звонкий звук /ð/ (как в английском артикле the). И буква Ββ больше не "бета", а "вита" (вы это могли заметить выше в слове "алфавит"). И вообще, в греческом больше нет звуков /b/ и /d/. Да, совсем нет (ну, почти).
Наконец, вернёмся к химической номенклатуре. Согласно правилам ИЮПАК, вновь открытым элементам даются временные названия (по систематической номенклатуре). Каждая цифра трёхзначного порядкового номера элемента переводится в некоторый греческий или латинский корень, обозначающий числительное. Корни выбраны таким образом, чтобы никакие два из них не начинались на одну и ту же букву латинского алфавита (поэтому и понадобились оба алфавита).
Полный список корней:
0: nil / нил
1: un / ун
2: bi / би
3: tri / три
4: quad / квад
5: pent / пент
6: hex / гекс
7: sept / септ
8: oct / окт
9: enn / енн
После этого три корня объединяются и к ним добавляется латинский суффикс -ium (в русском, соответственно, -ий). При этом если порядковый номер элемента заканчивается на 2 или 3 (корни bi и tri), то корень сокращают на одну букву перед суффиксом -ium (чтобы избежать двух ⟨i⟩ подряд), а если после цифры 9 (enn) идёт 0 (nil), то в корне также убирают последнюю букву (чтобы избежать трёх ⟨n⟩ подряд). Символ элемента образуется из первых букв каждого из трёх корней (при этом самая первая буква символа – заглавная).
Вот названия последних шести известных на сегодняшний день элементов:
113: Ununtrium/Унунтрий (он же Nihonium/Нихоний – в честь Японии);
114: Ununquadium/Унунквадий (он же Flerovium/Флеровий – в честь Георгия Флёрова);
115: Ununpentium/Унунпентий (он же Moscovium/Московий – в честь Московской области);
116: Ununhexium/Унунгексий (он же Livermorium/Livermorium – в честь Ливерморской национальной лаборатории);
117: Ununseptium/Унунсептий (он же Tennessine/Теннессин – в честь штата Теннесси);
118: Ununoctium/Унуноктий (он же Oganesson/Оганесон – в честь Юрия Оганесяна).
После присвоения официального названия временные названия по систематической номенклатуре уже не используются (т.к. в этом нет необходимости), но, например, ещё не открытые элементы 119 и 120 сейчас называются Ununennium/Унуненний и Unbinilium/Унбинилий. И обозначаются, соответственно, Uue и Ubn.
Тем не менее, совершенно никто не запрещает нам дать систематическое название водороду: это вынесенный в заголовок Nilnilunium/Нилнилуний (т.е. элемент 001) – обозначается Nnu.
А теперь вопрос: действительно ли водород – первый элемент периодической системы? Как думали раньше? Как думают сейчас? Что по этому поводу думал сам Менделеев?
Собственно, статья и родилась из попытки ответить на этот вопрос (с лёгким попутным экскурсом в этимологию). Возможные варианты ответов можно обсудить в комментариях (и продолжить в следующей статье).